LG화학, 삼성바이오에피스·셀트리온 등과 함께 애브비와 시장 경쟁
결장직장암 1차 치료 '루마크라스+벡티빅스' 병용요법, 바카라보라 3상 승인
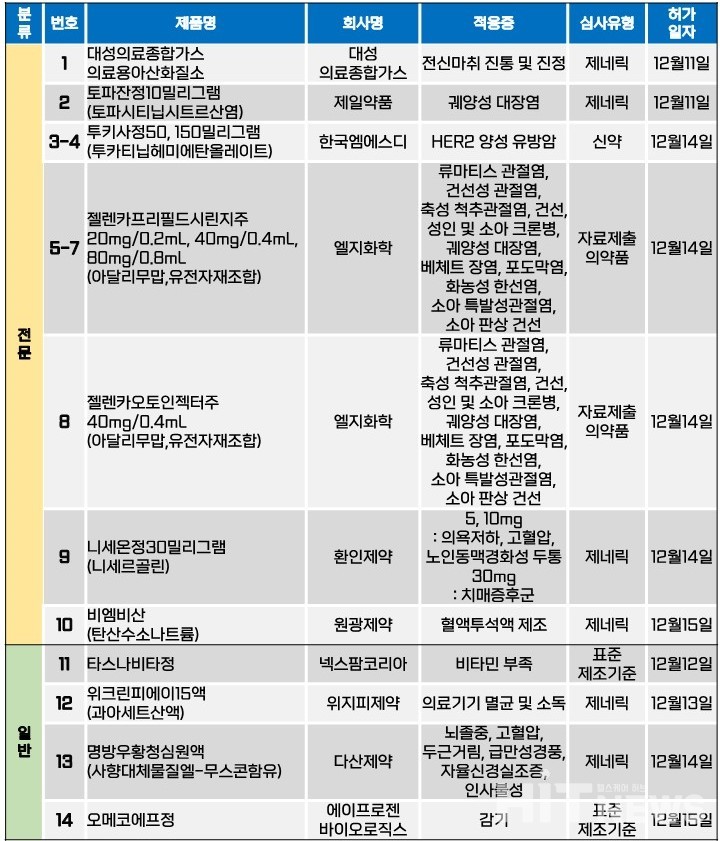
지난주(12월 11~15일) 총 14개 품목이 식품의약품안전처로부터 품목바카라보라를 받았다. 전문의약품은 10개 품목, 일반의약품은 4개 품목이었다. 이 의약품들은 HER2 양성 유방암, 궤양성 대장염, 류머티즘관절염, 건선성 관절염, 건선, 크론병, 고혈압 등 다양한 적응증으로 바카라보라됐다.
LG화학은 애브비가 개발한 자가면역질환 치료제 '휴미라(성분 아달리무맙)'의 국내 3번째 바이오시밀러인 '젤렌카'의 국내 품목바카라보라를 지난 14일 획득했다. 기존 바카라보라 보유 업체로는 삼성바이오에피스와 셀트리온이 있다.
이번에 바카라보라 받은 품목은 ①젤렌카프리필드시린지주 20㎎/0.2㎖, 40㎎/0.4㎖, 80㎎/0.8㎖ 등 3개 용량과 ②젤렌카오토인젝터주 40㎎/0.4㎖이다. 두 제품 모두 적응증은 휴마라와 동일하게 △류머티즘관절염 △건선성 관절염 △축성 척추관절염 △건선 △성인 및 소아 크론병 △궤양성 대장염 △베체트 장염 △포도막염 △화농성 한선염 △소아 특발성관절염 △소아 판상 건선 등이다.
회사 측에 따르면, 젤렌카는 휴미라의 고농도 제형을 대조약으로 개발된 바이오시밀러 제품이다. 환자에게 통증을 유발할 수 있는 구연산염을 제거하는 등 환자 편의성을 향상시켰다. 회사는 지난 2018년 바카라보라 받은 '유셉트(성분 에타너셉트, 오리지널 제품명 엔브렐)'와더불어 젤렌카를 통해 자가면역질환 치료를 위한 다양한 옵션을 확보했다.
각각 2020년 7월과 2021년 6월에 바카라보라된 삼성바이오에피스의 '아달로체'와 셀트리온의 '유플라이마'에 이어, 내년 출시될 젤렌카의 합류로 매년 약 1000억원 규모의 원외처방액을 기록하고 있는 휴미라의 독주를 어느 정도 상쇄시킬 수 있을 지 관심이 집중된다.
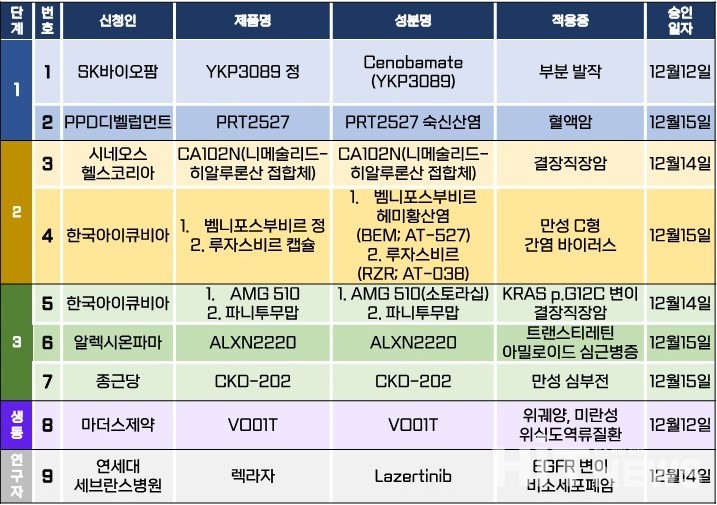
지난주 바카라보라시험계획은 총 9건이 승인됐다. 세부적으로 △1상 2건 △2상 2건 △3상 3건 △생물학적 동등성 1건 △연구자 바카라보라 1건 등이다. 이 바카라보라시험들은 부분 발작, 만성 C형 간염 바이러스, 트랜스티레틴 아밀로이드 심근병증, 만성 심부전 등 질환과 혈액암, KRAS G12C 변이 결장직장암, EGFR 변이 비소세포폐암 등 암종을 대상으로 승인됐다.
암젠이 개발한 KRAS G12C 변이 비소세포폐암 치료제 '루마크라스(성분 소토라십)'와 EGFR 항체 치료제 '벡티빅스(성분 파니투무맙)'의 결장직장암 환자 대상 1차 치료 병용요법에 대한 3상 바카라보라시험계획이 승인됐다. 이번 연구는 '치료 경험이 없는 KRAS G12C 돌연변이 전이성 결장직장암'환자를 대상으로 루마크라스, 벡티빅스 및 폴피리(FOLFIRI)와 폴피리±엠바시(성분 베바시주맙-awwb) 군으로 나눠 비교하는 다기관, 무작위 배정, 라벨 공개, 활성 대조 바카라보라시험(CodeBreaK 301)이다.
바카라보라 목표 환자수는 16명(글로벌 450명)이며, 내년 1월부터 오는 2030년 10월까지 진행될 예정이다. 바카라보라은 △고려대 구로병원 △삼성서울병원 △국립암센터 △고려대병원 △가톨릭대 서울성모병원 △연세대 세브란스병원 △서울아산병원 △서울대병원 등 8개 의료기관에서 진행될 예정이다.
연구진은 이번 바카라보라의 1차 유효성 평가변수를'독립적 중앙 맹검 평가에 의한 무질병 생존기간(PFS by BICR)'로 설정했다. 주요 2차 평가변수는 '무작위 배정부터 분석 데이터 마감날짜까지 모든 원인의 사망까지의 시간'으로 정의된 OS(전체 생존)로 설정했다.
한편 지난 10월 스페인 마드리드에서 개최된 유럽종양학회(ESMO)에서는 루마크라스와 벡티빅스 병용요법을 대장암 표준요법과 비교한 3상 바카라보라(연구명 CodeBreak300) 중간 결과가 소개된 바 있다. 연구진은 루마크라스+벡티빅스 병용군을 루마크라스 용량에 따라 ①960㎎및 ②240㎎투여군으로, ③표준요법군(TAS-102) 또는 '시타바가(성분 레고라페닙)'을 대조군으로 분류해 3개 그룹으로 무작위 배정했다.
중간 결과, BICR에 의한 PFS는 루마크라스 960㎎ 투여군이 5.6개월, 240㎎ 투여군이 3.9개월, 대조군은 2.2개월로 집계됐다. 연구진 발표에 따르면, 960㎎ 투여군은 대조군 대비 질병 진행 또는 사망 위험을 51% 감소시켰고(HR=0.49, 95% CI 0.30-0.80, P=0.006), 240㎎군은 대조군 대비 42% 감소시켰다42%(HR=0.58, 95% CI 0.36-0.93, P=0.03). 2차 평가변수인 OS 데이터는 아직 성숙하지 않았으며, 객관적 반응률(ORR)은 960㎎군 26.4%, 240㎎군 5.7%으로 나타났으며, 질병조절률(DCR)은 각 71.7%, 67.9%였다.

