2월, 16개 신약ㆍ개량신약 카지노 엘에이…NDA 11건ㆍBLA 5건
경구용 NF1 치료제 '고메클리'ㆍ주2회 TGCT 치료제 '롬빔자' 카지노 엘에이
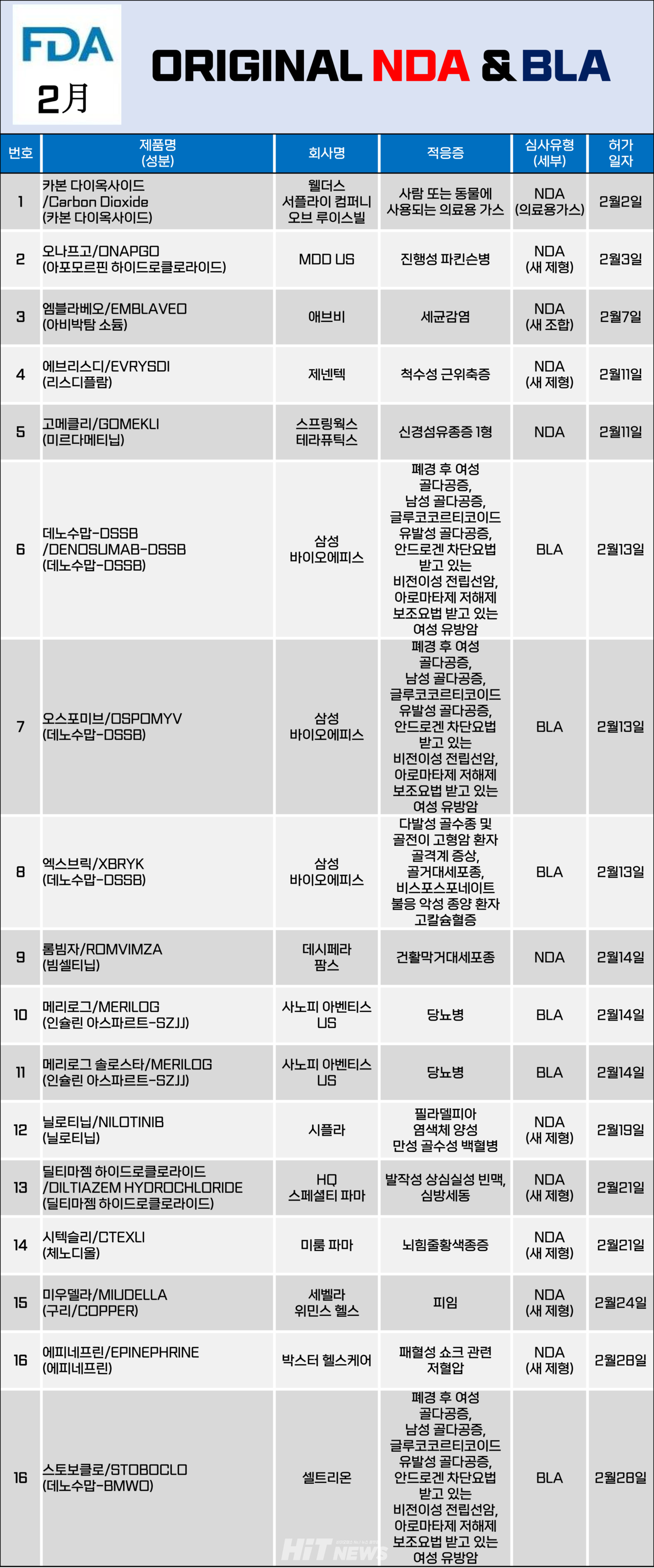
지난달총 16개 제품이 미국 식품의약국(FDA)로부터 신약 또는 개량신약으로 카지노 엘에이됐다. 주로 저분자의약품을 대상으로 하는 신약 카지노 엘에이 신청(New Drug application·NDA)은 11건, 생물의약품 카지노 엘에이 신청(Biologics Licensing Applications·BLA)은 5건이 승인됐다.
대상 적응증은 진행성 파킨슨병, 척수성 근위축증, 신경섬유종증 1형, 골다공증, 당뇨병, 건활막거대세포종, 만성 골수성 백혈병, 뇌힘줄황색종증 등이었다.
국산 '프롤리아·엑스지바'바이오시밀러 카지노 엘에이

지난 2월 삼성바이오로직스와 셀트리온이 개발한 데노수맙 성분 바이오시밀러가 4건이 카지노 엘에이됐다.
미국 FDA는 2월 13일 삼성바이오에피스가 개발한 프롤리아 시밀러 '오스모피브(OSPOMYV)'와 '데노수맙-DSSB'그리고 엑스지바 시밀러 '엑스브릭(XBRYK)'을 카지노 엘에이했다. 또, 28일에는 셀트리온이 개발한 프롤리아 시밀러 '스토보클로(STOBOCLO)'가카지노 엘에이했다.
프롤리아와 엑스지바는 암젠이 개발한 데노수맙 성분의 골흡수 억제제다. 각 제제별로 용량과 투약 주기에 차이가 있어프롤리아는 △폐경 후 여성 골다공증 △남성 골다공증 △글루코코르티코이드 유발성 골다공증 △안드로겐 차단요법을 받고 있는 환자의 비전이성 전립선암 △아로마타제 저해제 보조요법을 받고 있는 환자의 유방암 등 적응증을,엑스지바는 △다발성 골수종 및 골전이 고형암 환자의 골격계 증상 △골거대세포종 △비스포스포네이트 불응 악성 종양 환자의 고칼슘혈증 등의 적응증을 가진다.
삼성바이오에피스는 이번 미국 카지노 엘에이와 함께 유럽 EMA의 품목카지노 엘에이도 획득하게 됐다. 제품명은 엑스지바 시밀러의 경우 미국과 동일하게 엑스브릭이지만, 프롤리아 시밀러는 '오보덴스(Obodence)'로 정했다.
셀트리온은 2월 내에 프롤리아 시밀러 스토보클로 만을 미국 FDA로부터 카지노 엘에이 받았다. 이후 3월 엑스지바 시밀러 오센벨트(OSENVELT)도 카지노 엘에이 받았다고 4일 밝혔다. 카지노 엘에이 적응증은 삼성바이오에피스와 마찬가지로 오리지널과 동일하다. 회사는 빠르면 연내 미국 시장에 두 제품을 출시한다는 계획이다.
희귀질환 신경섬유종증 1형 치료제 '고메클리'
미국 바이오기업 스프링웍스 테라퓨틱스(SpringWorks Therapeutics)가 개발한 신경섬유종증 1형(NF1) 치료제 '고메클리(GOMEKLI, 성분 미르다메티닙)'가 지난 11일 미국 FDA로부터 카지노 엘에이됐다. 카지노 엘에이 제형은 1mg 및 2mg 캡슐과 경구 현탁액용 1mg 정제다.
신경섬유종증 1형은 체내 신호전달 체계인 MAPK 경로를 억제하는 NF1 유전자의 돌연변이로 인해 발생하는 희귀질환이다. 약 2500명의 출생아 중 1명에서 발생하는 것으로 알려졌으며, 미국에서만 10만명의 환자가 있을 것으로 추산된다. 환자들은 비정상적인 색소 침착, 골격 변형, 종양 성장 및 인지 장애와 같은 신경학적 합병증 등이 발생한다.
이번 카지노 엘에이로 고메클리는 신경섬유종 1형 관련 증상성 망상 신경섬유종(NF1-PN) 성인 및 소아(2세 이상) 환자에 사용될 수 있게 됐다.
고메클리의 주요 카지노 엘에이 임상인 'ReNeu' 2b상 연구 결과, 수술적 절제가 불가능한 NF1-PN 환자(성인 58명, 소아 56명)에서 고메클리 투여군 성인에서 41%, 소아에서 52%의 객관적 반응률(ORR)을 보였다. 또, 종양 부피 감소가 깊게 나타났고, 내약성을 보였다.
신경섬유종의 부피의 최적 백분율 변화 중앙값은 고메클리 투여군 성인의 경우 41%(95% CI : -90~13%), 소아의 경우 -42%(95% CI : -91~48%)로 나타났다.또, 반응이 확인된 성인의 88%와 소아의 90%는 최소 12개월 동안 반응이 지속됐고, 이 중 각 50%와 48%는 24개월 동안 이어졌다. 환자 보고 결과(PRO)에서 평가된 통증과 삶의 질도 유의미한 개선을 보였다.
가장 흔하게 보고된 이상반응(25% 초과)은 발진, 설사, 오심, 근골격계 통증, 구토 및 피로 등이었다.
회사는 골메클리의 환자 접근성을 높이기 위해 환자 지원 프로그램 'CareConnections'를 운영하고, 미국 내 생물의약품 취급 약국 및 유통망을 통해 2주 내 출시하겠다는 방침이다.
주 2회로복용 기간 늘린 건활막거대세포종 치료제 '롬빔자'

데시퍼라 파마슈티컬스(Deciphera Pharmaceuticals)이 개발한 건활막거대세포종(TGCT) 치료제 '롬빔자(ROMVIMZA, 성분 빔셀티닙)'가 지난 2월 14일 미국 FDA에 카지노 엘에이됐다.
일본계 제약사인 오노약품공업은 작년 4월 데시퍼라를 24억 달러에 인수하며 다양한 항암 파이프라인을 확보했는데, 롬빔자는 그 중 하나다.
인산화효소 억제제 계열 약제인 롬빔자는 수술적 절제로 인해 기능적 제한이 악화되거나 심각한 이환율이 나타날 수 있는 증상의 성인 건활막거대세포종 환자의 치료에 사용될 수 있도록 카지노 엘에이됐다.
이번 카지노 엘에이는 수술이 불가능한 TGCT 환자 중 이전에 항-CSF1/CSF1R 요법을 받지 않은 환자(이마티닙 또는 닐로티닙 요법은 허용)를 대상으로 진행한 3상 임상 'MOTION'연구를 바탕으로 이뤄졌다. 연구에는 123명의 환자(롬빔자 투여군 83명, 위약군 40명)가 참여했다.
연구 결과, 독립 맹검 방사선 검토(BIRR)를 통해 평가한 치료 의도군(ITT)은 치료 25주차에 통계적 임상적으로 유의미한 객관적 반응률을 보였다(롬빔자군 40%, 위약군 0%, p<0.0001). 반응 지속 기간(DOR) 중간값은 롬빔자 투여군에서 도달하지 않았으며, 추가 6개월 추적 관찰 결과 85%의 환자가 6개월 이상 반응을 유지했고, 58%의 환자가 9개월 이상 반응을 유지했다.
또한 임상에서 가장 흔하게 보고된 이상 반응(20% 이상)으로는 아스파르테이트&알라닌 아미노전이효소(AST&ALT) 증가, 눈 주위 부종, 피로, 발진, 콜레스테롤 증가, 말초 부종, 안면 부종, 호중구 감소, 백혈구 감소, 가려움증 등이었다. 이상반응은 관리 가능한 수준(manageable)으로 나타났으며, 기존 진행했던 1/2상 연구에서 나타났던 결과와 일치했다.
한편, 기존 건활막거대세포종 치료제로 사용되던 약제로는 2019년 카지노 엘에이된 다이이찌산쿄의 '투랄리오(성분 펙시다티닙)'이 있다.
오노약품공업은 롬빔자의 장점을 투랄리오 대비 긴 투약 기간과 안전성으로 꼽고 있다. 투랄리오는 1일 2회 복용해야 하는 반면, 롬빔자는 주 2회(최소 72시간 간격)만 복용하면 된다. 또한, 투랄리오는 심각한 간 독성(hepatotoxicity) 위험 경고 문구(black box warning)를 포함하고 있는데, 롬빔자는 이를 포함하고 있지 않다.

